第十六问:注册人进行产品注册按照第二类医疗器械产品(含体外诊断试剂)首次注册需提交哪些资料?
办理条件
1. 申报注册的产品已经列入《医疗器械分类目录》,且管理类别为第二类(注:对新研制的尚未列入分类目录的医疗器械,申请人可以直接向国家药监局申请第三类医疗器械产品注册,也可以依据分类规则判断产品类别并向国家药监局申请类别确认后,申请产品注册或者办理产品备案)。
2. 申请人应当是在各省辖区范围依法进行登记的企业。
3. 申请人建立与产品研制、生产有关的质量管理体系,并保持有效运行。
4. 办理医疗器械注册事务的人员应当具有相应的专业知识,熟悉医疗器械注册或者备案管理的法律、法规、规章和技术要求,如:《医疗器械监督管理条例》《医疗器械注册管理办法》《医疗器械分类规则》《关于进一步做好医疗器械产品分类界定工作的通知》《关于发布医疗器械产品技术要求编写指导原则的通告》《医疗器械临床试验规定》《医疗器械临床评价技术指导原则》《医疗器械说明书和标签管理规定》等。
5. 申请人申请注册,应当遵循医疗器械安全有效基本要求,保证研制过程规范,所有数据真实、完整和可溯源。
6. 申请注册的资料应当使用中文。根据外文资料翻译的,应当同时提供原文;引用未公开发表的文献资料时,应当提供资料所有者许可使用的证明文件;申请人对资料的真实性负责。
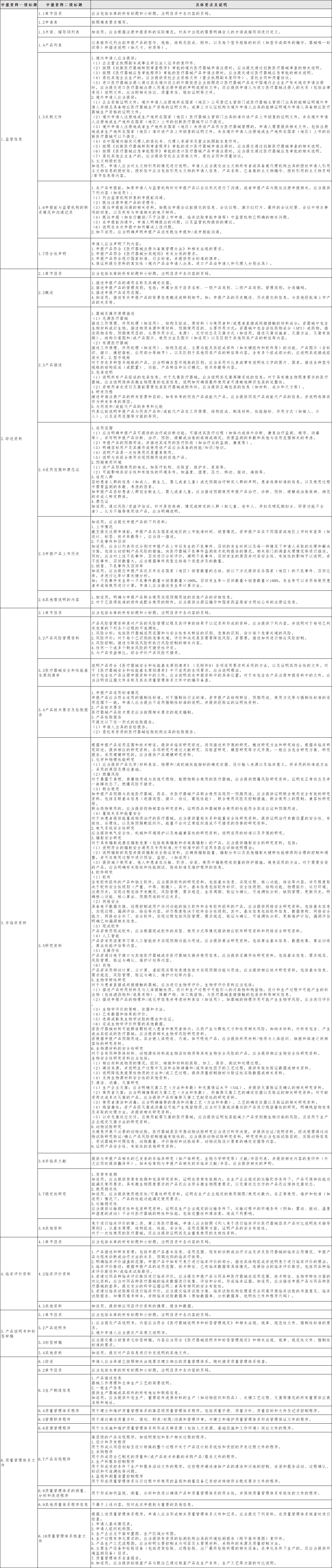
所需资料
办理时限说明
法定期限:申报资料不齐全或者不符合形式审查要求的,应当在5个工作日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申报资料之日起即为受理;自受理之日起3个工作日内转交技术审评机构,60个工作日内完成技术审评工作,技术审评结束后20个工作日内作出审批决定。自作出审批决定之日起10个工作日内发给医疗器械注册证。
技术审评环节的专家审评、质量管理体系核查、申请人补充资料的时间,不计算在审评时限内。省食品药品监督管理部门应当在30个工作日内根据相关要求完成体系核查。申请人应当在1年内按照补正通知的要求一次提供补充资料;技术审评机构应当自收到补充资料之日起60个工作日内完成技术审评。
承诺期限:在收到技术审评报告之日起,12个工作日内做出决定。自作出审批决定之日起10个工作日发给医疗器械注册证。技术审评、专家审评、注册体系核查、企业补充资料、补充资料后技术审查的时间不计入行政审批时限。
注:以上时限不包括技术审评时限、申请人补充材料时限。
【信息来源】国家药监局